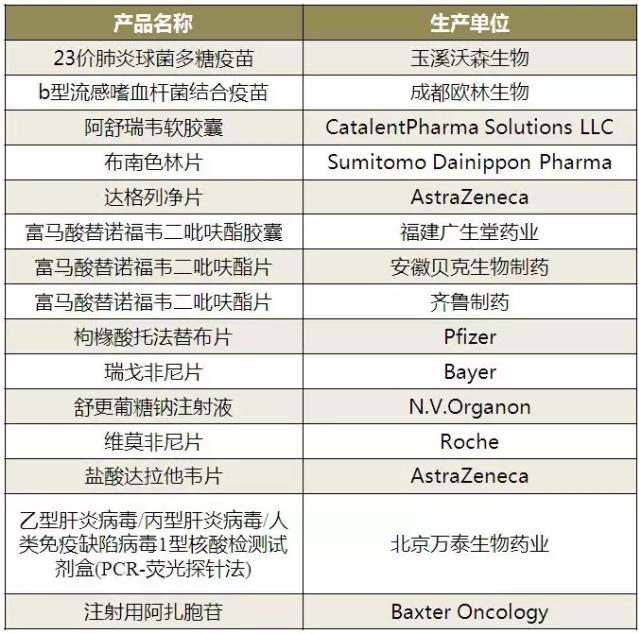
 (数据来源:咸达数据V3.2)
“双报”:注射剂申报注册活跃度高
一致性评价方面,“双报”企业-产品在美国已上市国内申报上市获批的速度就没有进口新药审批速度那样快了。
国内药品生产企业已在欧盟、美国或日本获准上市的仿制药,按照《关于发布化学药品注册分类改革工作方案的公告》(食品药品监管总局公告2016年第51号)的有关要求申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价。通过一致性评价的品种,由CFDA向社会公布。企业可在药品说明书、标签中予以标示体内评价和体外评价的标识。
如表2所示,海南普利制药有限公司注射用阿奇霉素2012年报产,2015年10月FDA暂时获批生产,2016年11月在国内获优先审评,至今未获批产,也未获通过一致性评价的标识。
“双报”企业并非所有产品已启动注册申报,如华海的帕罗西汀片、盐酸安非他酮缓释片、喹那普利片、盐酸强力霉素缓释片、奥美沙坦酯氢氯噻嗪片和盐酸度罗西汀肠溶胶囊,上海安必生的安非他酮缓释片等,都未在国内启动注册。
表2 “双报”企业-产品优先审评现状
(数据来源:咸达数据V3.2)
“双报”:注射剂申报注册活跃度高
一致性评价方面,“双报”企业-产品在美国已上市国内申报上市获批的速度就没有进口新药审批速度那样快了。
国内药品生产企业已在欧盟、美国或日本获准上市的仿制药,按照《关于发布化学药品注册分类改革工作方案的公告》(食品药品监管总局公告2016年第51号)的有关要求申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价。通过一致性评价的品种,由CFDA向社会公布。企业可在药品说明书、标签中予以标示体内评价和体外评价的标识。
如表2所示,海南普利制药有限公司注射用阿奇霉素2012年报产,2015年10月FDA暂时获批生产,2016年11月在国内获优先审评,至今未获批产,也未获通过一致性评价的标识。
“双报”企业并非所有产品已启动注册申报,如华海的帕罗西汀片、盐酸安非他酮缓释片、喹那普利片、盐酸强力霉素缓释片、奥美沙坦酯氢氯噻嗪片和盐酸度罗西汀肠溶胶囊,上海安必生的安非他酮缓释片等,都未在国内启动注册。
表2 “双报”企业-产品优先审评现状
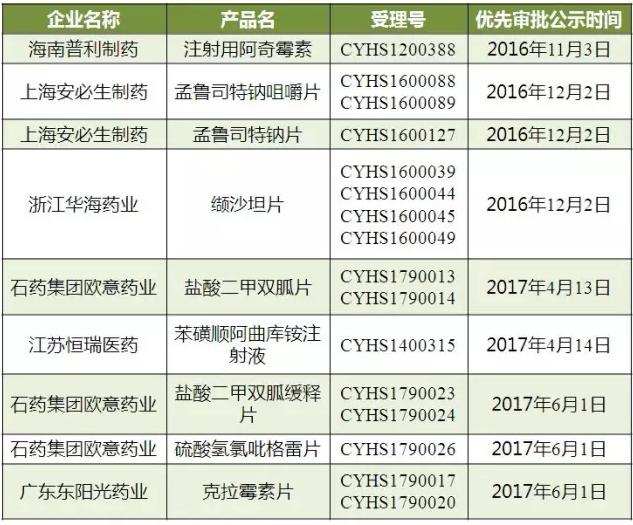 (数据来源:咸达数据V3.2)
2017年6月9日总局办公厅公开征求《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)(征求意见稿)》和《仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)(征求意见稿)》及相关单据意见,则意味着“双报”共线的产品将有望在下半年获得通过一致性评价的标识。
咸达数据V3.2分析目前国内和ANDA“双报”产品中销售潜力较大的发现,国内已上市注射剂的产品同步申报ANDA的较多。注射剂的上市再评价将要启动,预计5~10年左右时间基本完成已上市注射剂再评价工作。按2016年《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,“化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价”就包括了注射剂。
这意味“双报”的注射剂一旦获批一致性评价,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册,相关注射剂的其他药品生产企业将要加快启动一致性评价。
对于国内外皆上市的厂家来说,“双报”视同通过一致性评价的药品品种,社会保障部门将在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用,政策红利可期。
同品种药品通过一致性评价的生产企业达到3家以上的,卫生计生部门在药品集中采购等方面不再选用未通过一致性评价的品种。从表3来看,目前不少获得ANDA的产品厂家数为2家。国内企业需要关注走美国FDA的OTC申报渠道,该渠道相对比较便捷,如布洛芬片现在已通过的厂家有中山安士和大连美罗。
“双报”的口服药大多数都是国内在申报状态,目前国内上市注册申报和一致性评价是不同部门在负责,未上市产品最终能否优先审评并获得一致性评价称号,还有待CFDA理顺流程。
表3 销售规模较大的“双报”产品上市/申报现状
(数据来源:咸达数据V3.2)
2017年6月9日总局办公厅公开征求《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)(征求意见稿)》和《仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)(征求意见稿)》及相关单据意见,则意味着“双报”共线的产品将有望在下半年获得通过一致性评价的标识。
咸达数据V3.2分析目前国内和ANDA“双报”产品中销售潜力较大的发现,国内已上市注射剂的产品同步申报ANDA的较多。注射剂的上市再评价将要启动,预计5~10年左右时间基本完成已上市注射剂再评价工作。按2016年《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,“化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价”就包括了注射剂。
这意味“双报”的注射剂一旦获批一致性评价,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册,相关注射剂的其他药品生产企业将要加快启动一致性评价。
对于国内外皆上市的厂家来说,“双报”视同通过一致性评价的药品品种,社会保障部门将在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用,政策红利可期。
同品种药品通过一致性评价的生产企业达到3家以上的,卫生计生部门在药品集中采购等方面不再选用未通过一致性评价的品种。从表3来看,目前不少获得ANDA的产品厂家数为2家。国内企业需要关注走美国FDA的OTC申报渠道,该渠道相对比较便捷,如布洛芬片现在已通过的厂家有中山安士和大连美罗。
“双报”的口服药大多数都是国内在申报状态,目前国内上市注册申报和一致性评价是不同部门在负责,未上市产品最终能否优先审评并获得一致性评价称号,还有待CFDA理顺流程。
表3 销售规模较大的“双报”产品上市/申报现状
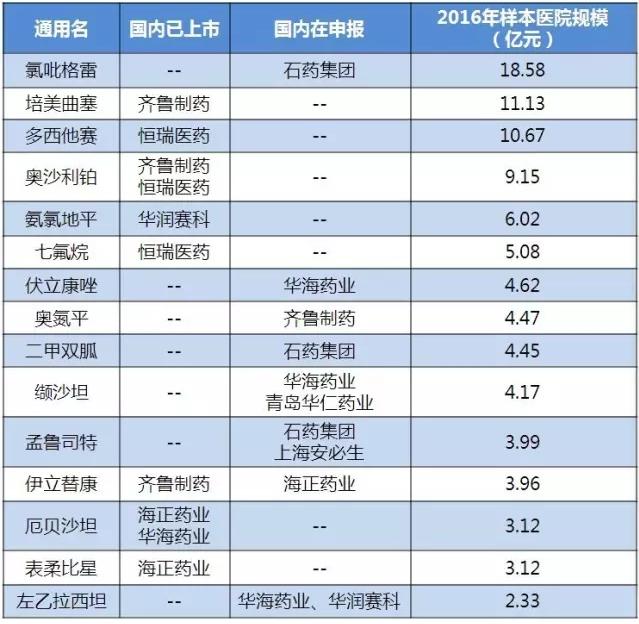 (数据来源:咸达数据V3.2)
小结>>>
临床自查核查2033个受理号,按CFDI《药物临床试验数据核查阶段性报告(2015年7月-2017年6月)》仅剩下146受理号待查,其中2015年117号公告的受理号待查的只剩2个受理号。这意味着自查核查清单中,能够获批的上市批文中,90%已经获得批文,剩下的少量上市批文则有望在2017年底全部获批。
从目前获批的情况来看,仿制药口服药获批数量较少,申报“成功率”较低,短期内有望获批的只能是双报的产品,但是何时能上市仍待观察CFDA下一步进展。已上市化学药产品的国内生产厂家三个以内的将继续享受政策红利。
(数据来源:咸达数据V3.2)
小结>>>
临床自查核查2033个受理号,按CFDI《药物临床试验数据核查阶段性报告(2015年7月-2017年6月)》仅剩下146受理号待查,其中2015年117号公告的受理号待查的只剩2个受理号。这意味着自查核查清单中,能够获批的上市批文中,90%已经获得批文,剩下的少量上市批文则有望在2017年底全部获批。
从目前获批的情况来看,仿制药口服药获批数量较少,申报“成功率”较低,短期内有望获批的只能是双报的产品,但是何时能上市仍待观察CFDA下一步进展。已上市化学药产品的国内生产厂家三个以内的将继续享受政策红利。







